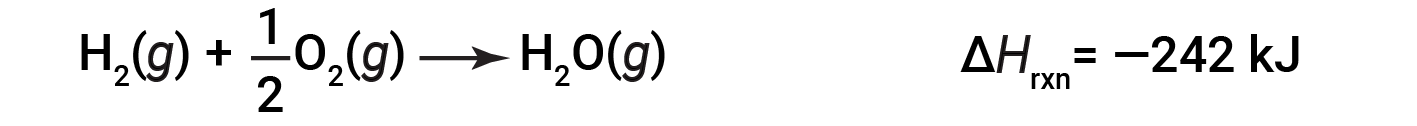6.7: 热化学方程
对于在恒定压力下进行的化学反应(系统)只做膨胀或收缩引起的工作&ndash;反应的焓(也称为反应热,Δ H rxn )等于与周围环境交换的热( q < sub> p )。
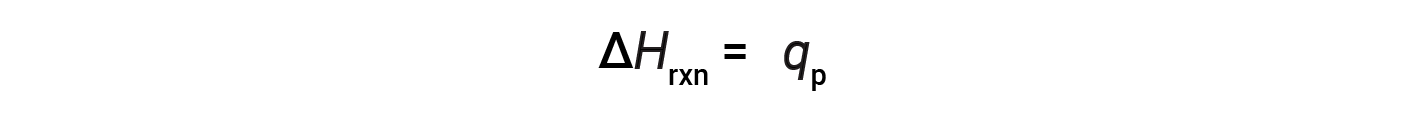
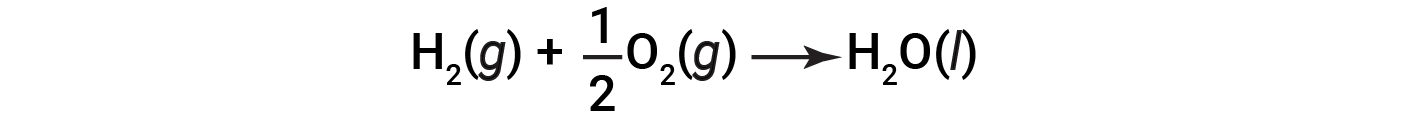
该方程式表明,向周围环境释放了286 kJ的热量。换句话说,对于消耗的每摩尔氢气或所产生的每摩尔水,释放出286 kJ的热量(反应是放热的)。因此,反应焓是一个转换因子,可用于计算在涉及特定量的反应物和产物的反应过程中释放或吸收的热量。
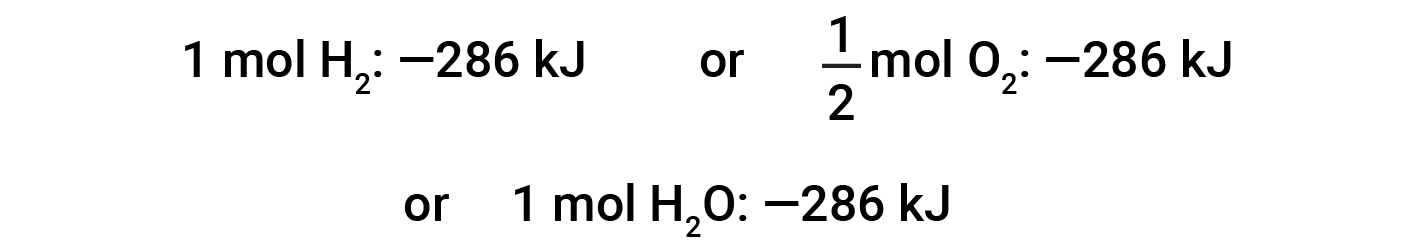
如果化学方程式的系数乘以某个因子(即,如果一种物质的量发生了变化),那么焓变必须乘以相同的因子。
(数量增加了两倍)
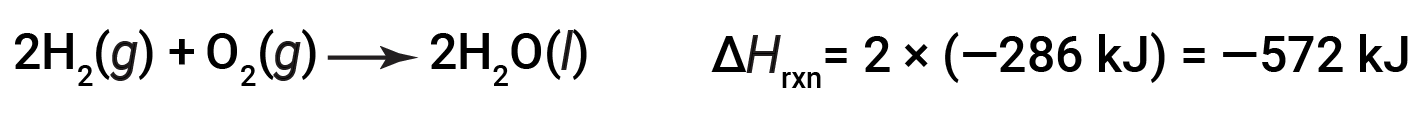
(数量减少了两倍)
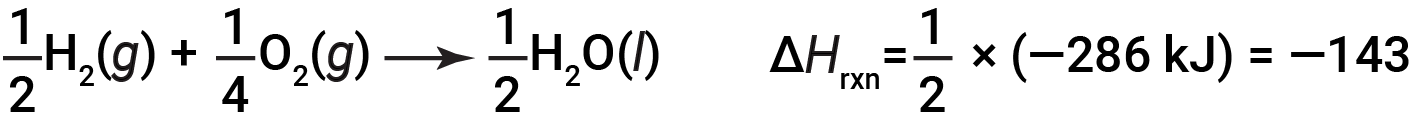
为说明反应的焓变取决于反应物和产物的物理状态,请考虑形成气态水(或水蒸气)。当1摩尔的氢气和 ½ 摩尔的氧气反应生成1摩尔的气态水,仅释放242 kJ的热量,而液态水形成时释放286 kJ的热量。