18.9: 腐食
金属が自然の電気化学的プロセスによって劣化することを腐食といいます。鉄の錆び、銀の変色、銅の青緑色の錆などは腐食の一例です。腐食は、金属の酸化を伴う。銅やアルミニウムの酸化のように、表面に金属酸化物やその誘導体の保護層が形成され、下地の金属がさらに酸化されないよう保護される場合もあります。また、鉄の錆びのように、金属全体を破損させる場合もあります。
好ましくない酸化還元反応の例: 鉄の錆び
錆は、鉄が酸素や水にさらされることで生じます。錆が発生する理由は、鉄の表面にガルバニ電池が形成され、鉄(II)が生じるからです。鉄の表面に形成されたアノード(鉄の酸化)領域とカソード(酸素の還元)領域で起こる酸化還元反応には以下の通りです。
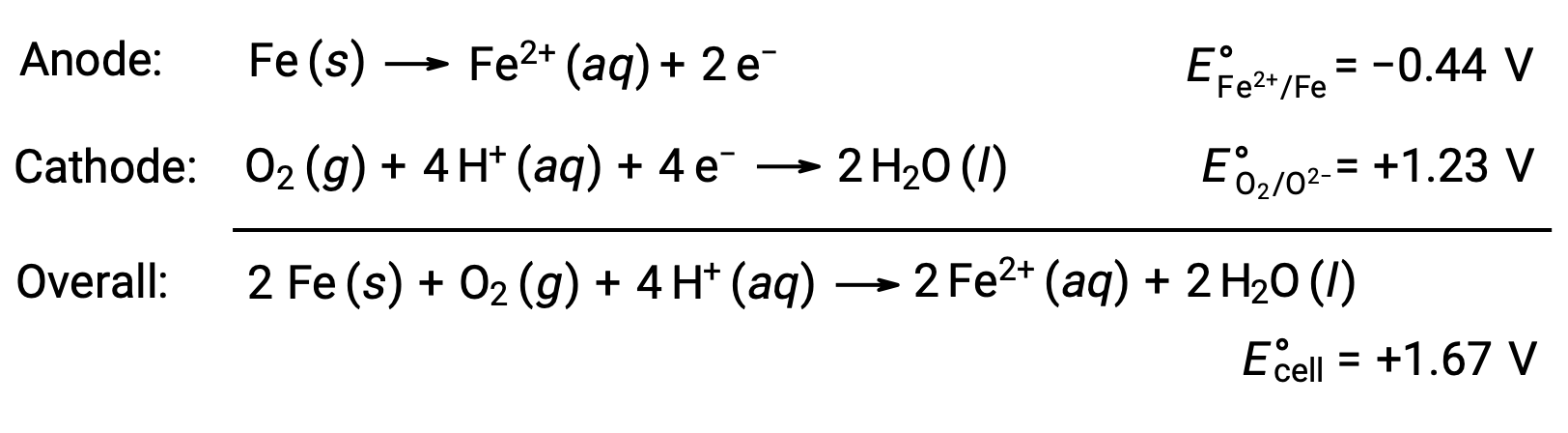
この鉄(II)は、さらに湿度の高い空気と反応して、鉄(III)の酸化物の水和物を形成します。これが一般に「錆」と呼ばれるものです。
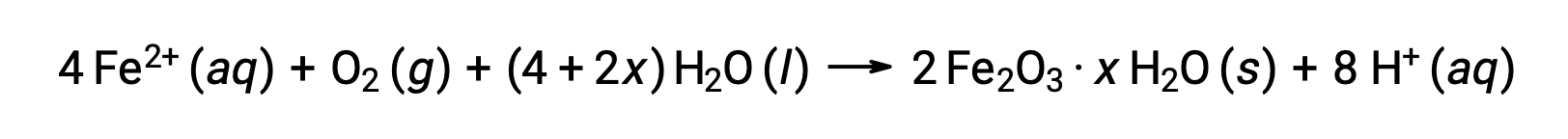
水和水の量は、化合物の式にxが使われていることからもわかるように、鉄(II)がさらされる水の量によって変化します。水分、酸や電解質の存在は、錆の生成速度を高めます。銅の緑青とは異なり、錆が形成されても保護層は形成されないため、錆が剥がれ落ちて新鮮な鉄が大気にさらされると、鉄の腐食がさらに進行します。
腐食の防止
腐食を防ぐには様々な方法があります。一つの方法は、金属の表面を塗装して水や酸素との接触を避けることです。また、鉄に少量のクロムを混ぜたステンレスのように、金属を合金化することも有効な防食方法です。クロムは表面近くに集まり酸化被膜を形成するため、鉄を効果的に腐食から守ることができます。
鉄やその他の金属は、亜鉛メッキによっても腐食を防ぐことができます。これは、保護すべき金属を、より酸化しやすい金属(通常は亜鉛)の層でコーティングするというものです。亜鉛層が無傷であれば、下地の鉄に空気が触れるのを防ぎ、腐食を防ぐことができます。亜鉛層が腐食や機械的な摩耗によって破損した場合でも、次で説明するカソード防食プロセスによって鉄を腐食から保護することができます。
カソード防食は、防食対象の金属を電気化学反応でカソードに変えるという原理を利用しています。これは、保護される金属を、犠牲アノードと呼ばれる亜鉛やマグネシウムなどのより酸化されやすい金属と接合することで起こります。アノードは腐食し、カソードとして機能する金属を保護するために消費されます。カソード防食は、給湯器や地下貯水槽などの家庭用電化製品に最もよく使われています。重要なことは、カソード防食は鉄以外の金属にも使用できるということです。
上記の文章は以下から引用しました。 OpenStax, Chemistry 2e, Chapter 17.6: Corrosion.


