14.9: 勒夏特列原理(Le Chatelier's Principle) :体积变化 (压力)
对于气相平衡,反应物和生成物的浓度会随着体积和压力的变化而变化。 理想气体的部分压力 P 与其摩尔浓度, M
成比例。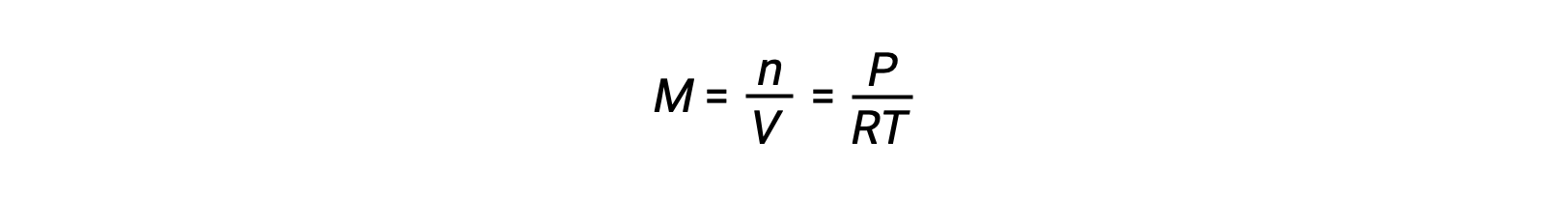
因此,任何反应物或生成物的分压的变化基本上是浓度的变化;因此,这些变化产率对平衡的影响是相同的。 除了添加或去除反应物或生成物之外,还可以通过更改系统占用的体积来改变气相平衡中物种的压力 (浓度)。 由于气体相平衡的所有物种都使用相同的体积,体积的给定变化将导致反应物和生成物的浓度发生相同的变化。 为了辨别这种类型的应力将引起何种位移 (如果有) ,必须考虑对反应的化学计量法。
在平衡状态下,反应商会描述反应N2 (g) + O2 (g) ⇌ 2 NO (g)
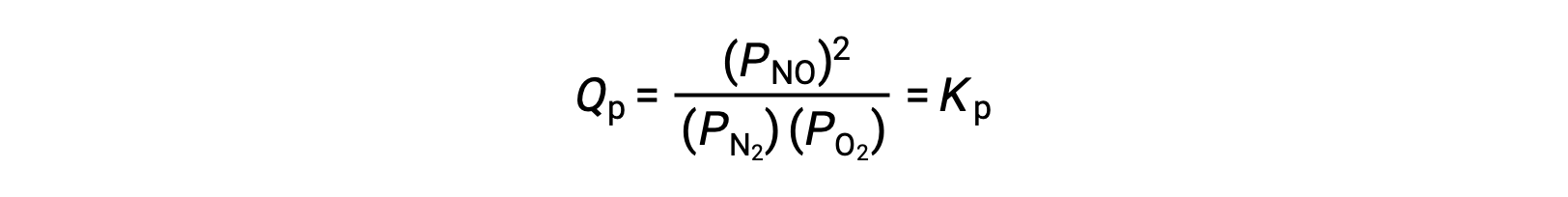
如果由这些物种的平衡混合物占据的体积被降低 3 倍,则所有三种物种的分压将被增加 3 倍:
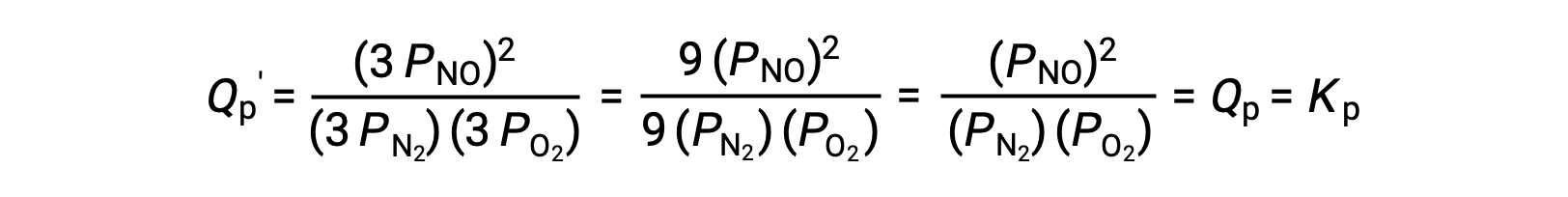
因此,改变这种气相平衡混合物的体积不会导致平衡的变化。
对不同系统的类似处理为 2 SO2 (g) + O2 (g) ⇌ 2 SO3 (g) ,但产率结果不同:
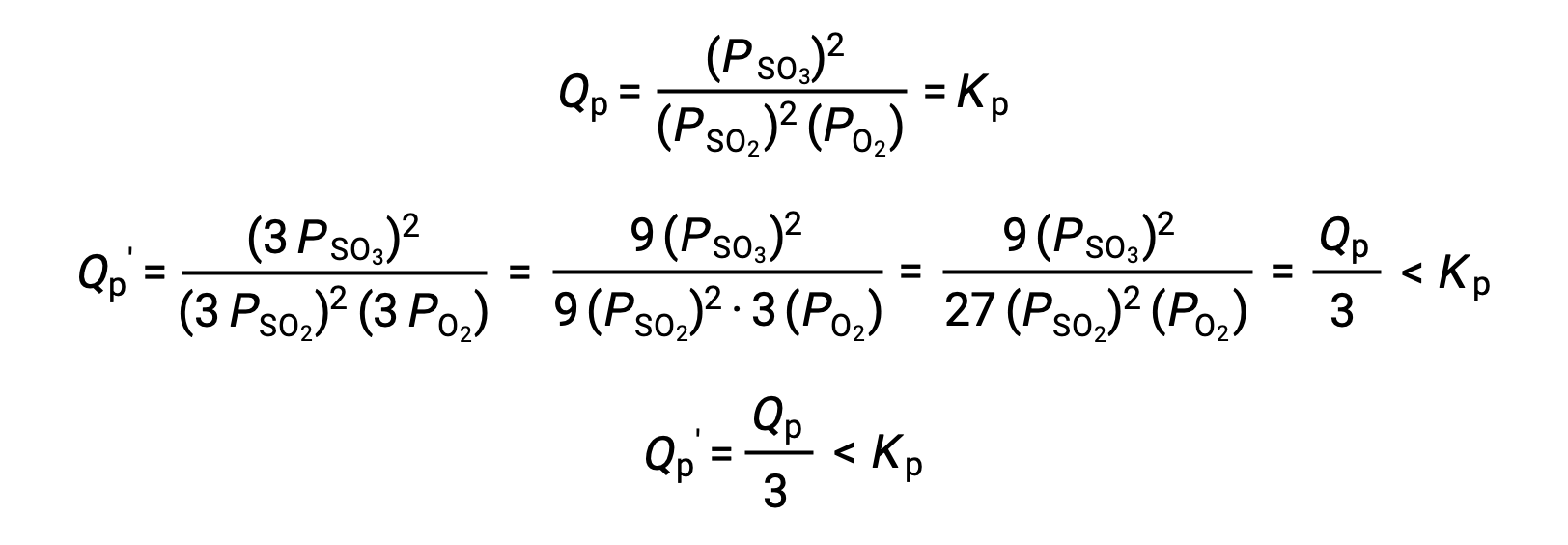
在这种情况下,体积的变化导致反应商小于平衡常数,因此平衡将向右移动。
这些结果说明了气体相平衡的化学测量与容积引起的压力 (浓度) 变化的影响之间的关系。 如果反应物和生成物的总摩尔量相等 (如第一个示例) ,体积的变化不会改变平衡。 如果反应物和生成物的摩尔量不同,体积的变化将使平衡向更好地“适应”体积变化的方向移动。 在第二个示例中,三摩尔的反应物 (SO2 和 O2) 产率两摩尔的生成物 (SO3) ,因此系统体积的降低会导致平衡发生向右移动,因为正向反应产生的气体 (2 摩尔) 比反向反应 (3 摩尔) 少。 相反,增加这一平衡系统的体积将导致向反应物的转变。
本文改编自 Openstax, 化学 2e, 第13.3节:平衡位移:勒夏特列原理(LeChatelier's Principle)。


