15.5: 共轭酸碱对的相对强度
布朗斯特-劳里 酸-碱 化学是质子的转移;因此,逻辑表明共轭酸碱对的相对强度之间的关系。 酸或碱的强度以其电离常数Ka 或Kb进行量化,表示酸或碱电离反应的范围。 对于共轭酸碱对 HA / A−,电离平衡方程和电离常数表达式是
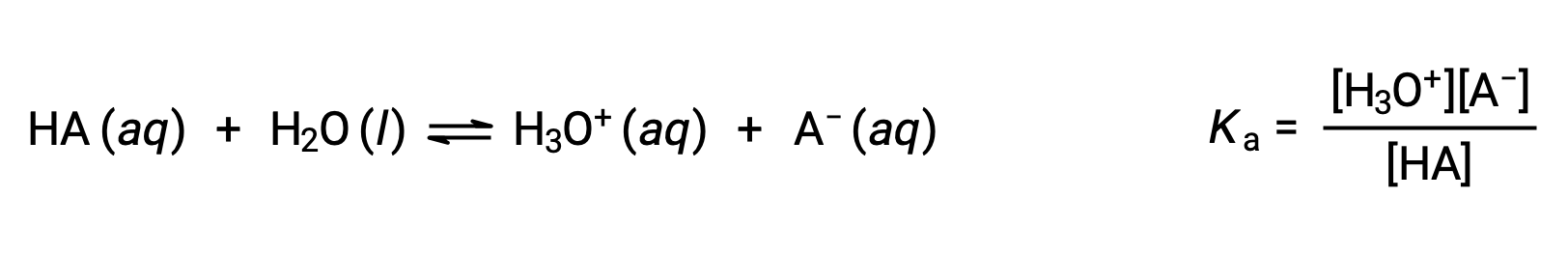
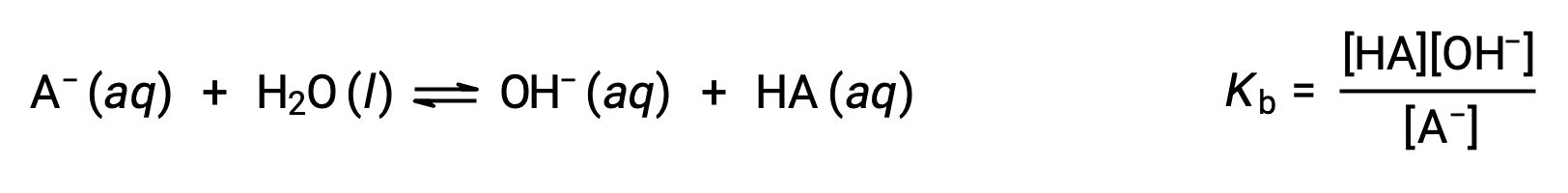
添加这两个化学式后得出水的自电离方程:
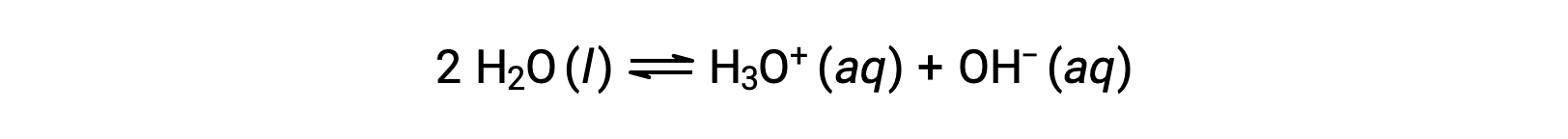
如前所述,一个求和反应的平衡常数等于添加反应的平衡常数的数学生成物,等等
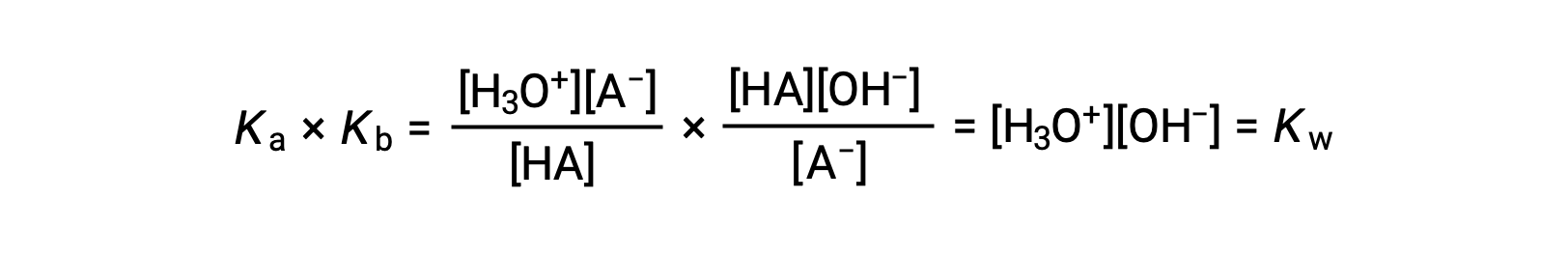
该方程表示任何共轭酸碱对的电离常数之间的关系,即其数学生成物等于水的离子生成物 KW。 通过重新排列此方程,共轭酸碱对的强度之间的互惠关系变得显而易见:
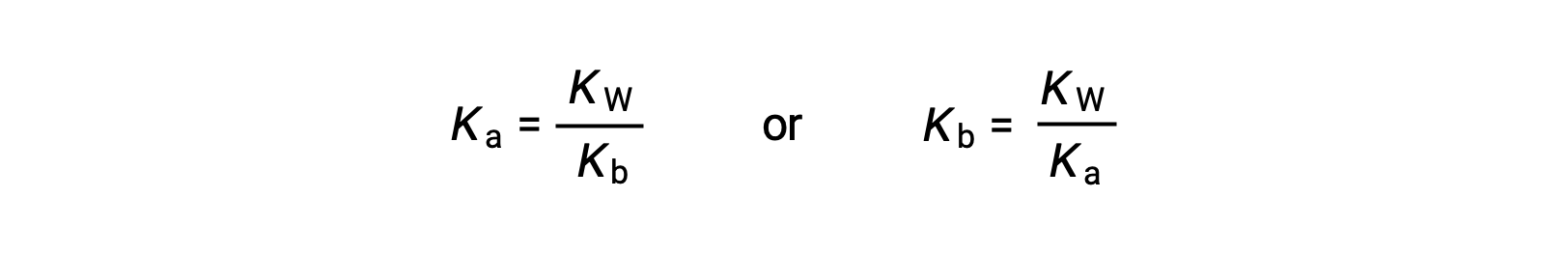
Ka 和Kb 之间的反比比例关系意味着酸或碱越强,其偶联物就越弱。
以方程两侧的负值记录, Ka × Kb = KW 得出
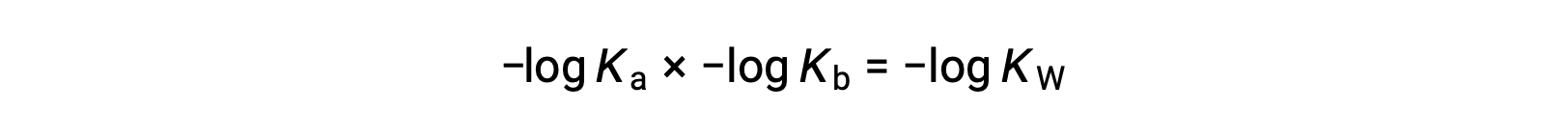
然后
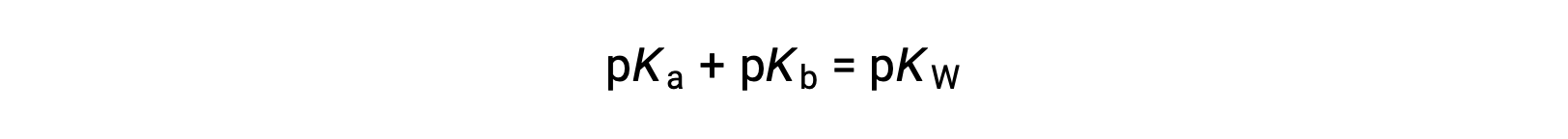
由于p K W 在25° C下为14,因此该等式也可以写为
p K a 和p K b 分别代表酸和碱的强度。 像pH和pOH一样,p K a 或p K b 值越高,酸或碱的值就分别越弱。 
所示的共轭酸碱基对列表的排列是为了显示每种物质与水相比的相对强度。在酸栏中,水之下列出的那些物质是弱于水的酸。这些物质在水中不会发生酸离子化;它们不是布朗斯特-劳里酸。水以上列出的所有物质均为强酸,当溶于水溶液中以产生水合氢离子时,质子会在一定程度上转移质子到水中。在水上但在水合氢离子以下的物种是弱酸,会发生部分酸电离,而在水合氢离子以上的物种是在水溶液中完全电离的强酸。
本文改编自 Openstax,化学 2e,第14.3节: 酸和碱的相对强度 。
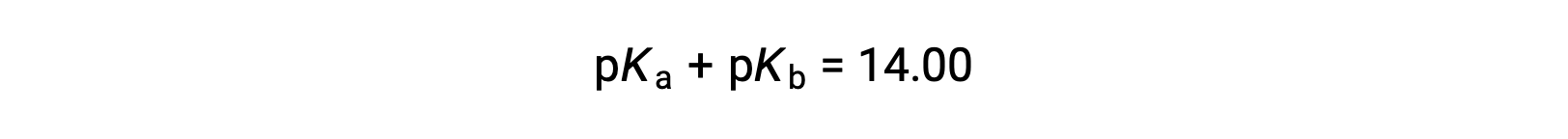
酸
碱
高氯酸 (HClO4)*
高氯酸盐离子 (ClO4−)**
硫酸 (H2SO4)*
硫酸氢离子 (HSO4−)**
碘化氢 (HI)*
碘化离子 (I−)**
氢溴 (HBr)*
溴化离子 (Br−)**
氯化氢 (HCl)*
氯化离子 (Cl−)**
硝酸 (HNO3)*
硝酸盐离子 (NO3−)**
水合氢离子 (H3O+)
水 (H2O)
硫酸氢离子 (HSO4−)
硫酸盐离子 (SO42−)
磷酸 (H3PO4)
磷酸二氢离子 (H2PO4−)
氟化氢 (HF)
氟化离子 (F−)
亚氮酸 (HNO2)
亚硝酸盐 (NO2−)
醋酸 (CH3CO2H)
醋酸盐离子 (CH3CO2−)
碳酸 (H2CO3)
碳酸氢离子 (HCO3−)
硫化氢 (H2S)
硫化氢离子 (HS−)
铵离子 (NH4+)
氨 (NH3)
氰化氢 (HCN)
氰化物离子 (CN−)
碳酸氢离子 (HCO3−)
碳酸盐 (CO32−)
水 (H2O)
氢氧化物离子 (OH−)
硫化氢离子 (HS−)†
硫化物离子 (S2−)‡
乙醇 (C2H5OH)†
环氧离子 (C2H5O−)‡
氨 (NH3)†
氨离子 (NH2−)‡
氢 (H2)†
氢化物离子 (H−)‡
甲烷 (CH4)†
甲基化离子 (CH3−)‡
*在水中进行完全酸离子化
† 不在水中发生酸离子化
**不在水中进行碱离子化
‡ 在水中进行完整的碱离子化
Tags
Conjugate Acid-base Pairs
Dissociation Constants
Weak Acid
Ka
Hydronium Ion Concentration
A Ion Concentration
Concentration Of HA
Base Dissociation Constant
Kb
Conjugate Base
Hydroxide Ion Concentration
Equilibrium Expression For Kw
Stronger Acid
Weaker Conjugate Base
Constant Value Of KW
Calculate Ka Or Kb
Negative Logarithms
PKa
PKb
PKW
Strengths Of Weak Acids


