6.4: 量化热量
热能 在微观上,热能是与原子和分子的随机运动相关的动能。温度是对“高温”的定量测量。或“冷”,这取决于热能的数量。当物体中的原子和分子快速移动或振动时,它们具有较高的平均动能(KE)(或较高的热能),并且物体被认为是“热”的,或者被描述为处于“高温”状态。更高的温度。当原子和分子缓慢移动时,它们具有较低的平均KE(或较低的热能),并且该物体被感知为“冷”或被描述为处于较低的温度。
假设没有化学反应或相变(例如熔化或汽化)发生,则增加物质样品中热能的数量将导致其温度升高,同时减少物质样品中的热能的数量会导致其温度下降。
热力
热量( q )是两个物体在不同温度之间的热能传递。热流会增加一个物体的热能,并降低另一个物体的热能。热从热到冷(即仅一个方向)自发流动,一直持续到两种物质处于相同温度。热量的变化是通过温度变化来衡量的。
热量、功和能量的国际单位制是焦耳。焦耳(J)定义为1牛顿的力使物体移动1米时使用的能量。它以纪念英国物理学家詹姆斯·普雷斯科特·焦耳(James Prescott Joule)的名字命名。 1焦耳等于1 kg m 2 / s 2 ,也称为1牛顿米。一千焦(kJ)为1000焦耳。为了使其定义标准化,将一种卡路里设置为等于4.184焦耳。
物体的热容( C )是指当温度发生变化(Δ< em> T )(摄氏1度)(或1开尔文):
吸热能力取决于吸收或释放热量的物质的类型和数量。因此,热容量是广泛的特性-它的值与物质的数量成正比。例如,考虑两个铸铁煎锅的热容量。大锅的热容量比小锅的热容量大五倍,因为尽管两者均由相同的材料制成,但大锅的质量却比小锅的质量大五倍。质量越大,意味着在更大的锅中存在更多的原子,因此需要更多的能量才能使所有这些原子更快地振动。通过观察将锅的温度提高50.0摄氏度(Δ 较大的铸铁煎锅虽然由相同的物质制成,但需要90,700 焦耳的能量( q )才能将其温度提高50.0摄氏度(Δ T )。较大的锅具(成比例地)具有较大的热容量,因为较大数量的材料需要(成比例地)较大量的能量来产生相同的温度变化:
一种物质的比热容( c ),通常称为“比热”。是将1克物质的温度提高1摄氏度(或1开尔文)所需的热量:
比热容仅取决于吸收或释放热量的物质的种类。这是一种密集的特性,因此它不依赖于物质的量。例如,小型铸铁煎锅的质量为808 克。因此,铁(用于制造锅的材料)的比热为:
大煎锅的重量为4040克。使用此锅的数据,我们还可以计算铁的比热:
尽管大锅比小锅大,但由于它们是用相同的材料制成的,因此它们产生的比热值相同(对于建筑材料,铁)。请注意,比热是以每质量温度的能量为单位进行测量的,是一种强度特性,它是从两个广泛特性(热量和质量)之比得出的。摩尔热容量也是一种增强性质,是每摩尔特定物质的热容量,单位为J / mol·℃(焦耳 / 摩尔⋅摄氏度)。
水具有相对较高的比热(对于液体为约4.2 J / g℃,对于固体为2.09J / g℃)。大多数金属具有低得多的比热(通常小于1 J / g·℃)。知道一种物质的质量( m )及其比热( c ),就可以确定热量, q ,进入或通过测量热量散失前后的温度变化(Δ T )离开物质:
如果物质获得热能,其温度将升高,其最终温度将高于其初始温度 T final &minus; T initial 的值为正,而 q 的值为正。如果物质失去热能,其温度会降低,最终温度会低于初始温度 T final &minus;。 T initial 的值为负,而 q 的值为负。
请注意,如果其他三个已知或可推导,则可以使用热量,比热,质量和温度变化之间的关系来确定这些量中的任何一个(不仅仅是热量)。
本文改编自 OpenStax 化学2e,第5.1节:能源基础和 OpenStax 化学2e,第5.3节:焓。
热能传递



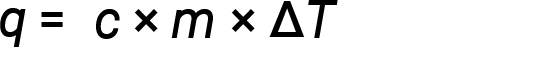
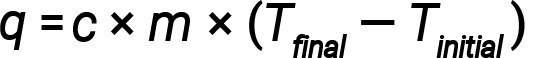
Tags
Heat
Internal Energy
Measure
Substance
Thermal Energy
Temperature
Heat Transfer
Joules
Celsius
Kelvin
Calorimetry
Iron
Water
Thermal Equilibrium
Isolated System
Temperature Change
Heat Capacity


