16.4: 计算缓冲溶液中的 pH 值变化
缓冲液可以防止在将强酸或碱增加到缓冲容量后溶液的 pH 值突然下降或升高;但是,这种增加强酸或碱确实会导致溶液的 pH 值轻微变化。 小 pH 值变化可通过确定计算得出缓冲液成分浓度的变化,即弱酸及其共轭碱,反之亦然。 使用这些化学化学当量计算得出的浓度可用于使用 亨德森-哈塞尔巴尔赫方程(Henderson-Hasselbalch Equation) 或 ICE表格 确定溶液的最终 pH 值。
例如,缓冲溶液含有 0.65 mol 的甲酸和钠甲酸。 由于弱酸的浓度及其共轭碱在这里是相同的,溶液的 pH 值等于弱酸的 pKa ,在本例中为 3.74。 如果将 0.05 mol HNO3 添加到该溶液中,则可通过化学化学计量计算来确定形成酸和形成钠的浓度的结果变化,如下表所示。
| H+ (AQ) | HCOO− (AQ) | HCOOH (AQ) | |
| 添加前 (M) | ~0.00 摩尔 | 0.65 摩尔 | 0.65 摩尔 |
| 新增 (M) | 0.050 摩尔 | -- | |
| 添加后 (M) | ~0.00 摩尔 | 0.60 摩尔 | 0.70 摩尔 |
然后,可以通过将改变的甲酸和甲酸钠浓度插入 亨德森-哈塞尔巴尔赫方程(Henderson-Hasselbalch Equation) 来确定溶液的最终 pH 值。
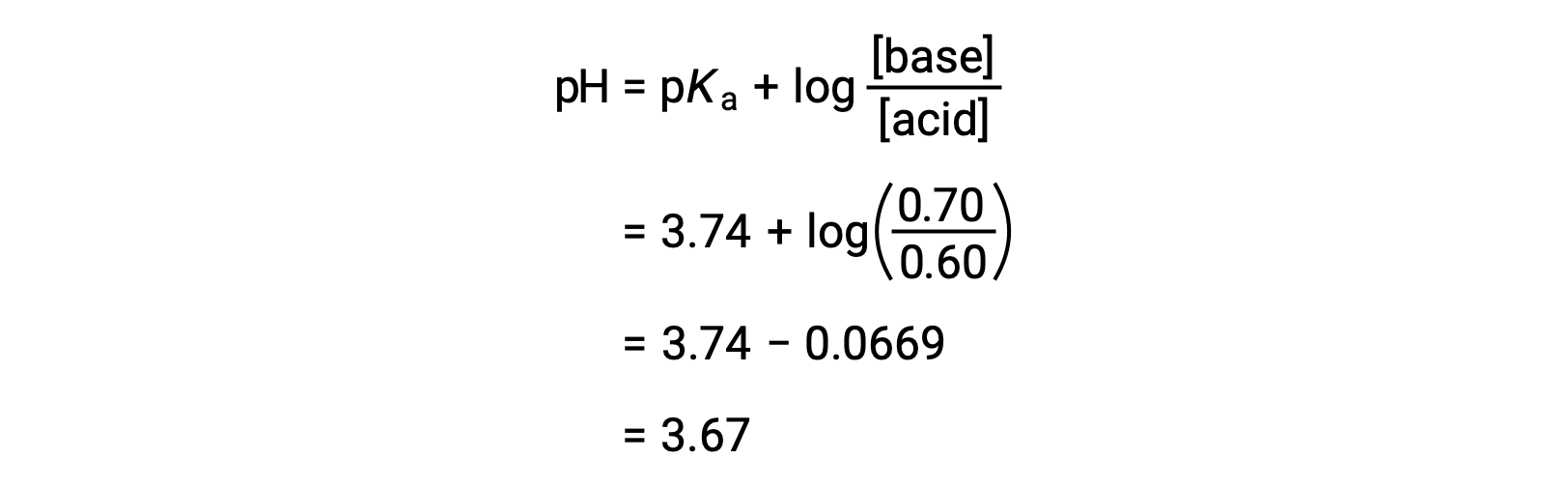
因此,增加 0.05 摩尔的 HNO3 可将溶液的 pH 值从 3.74 降至 3.67。
同样,如果将 0.10 mol NaOH 添加到同一个溶液中,则可通过化学计量计算来确定形成酸和形成钠的浓度的结果变化,如下表所示。
| OH− (AQ) | HCOOH (AQ) | HCOO− (AQ) | 水 (升) | |
| 添加前 (M) | ~0.00 摩尔 | 0.65 摩尔 | 0.65 摩尔 | - |
| 新增 (M) | 0.10 摩尔 | -- | | |
| 添加后 (M) | ~0.00 摩尔 | 0.55 摩尔 | 0.75 摩尔 | |
然后,可以通过将改变的甲酸和甲酸钠浓度插入 亨德森-哈塞尔巴尔赫方程(Henderson-Hasselbalch Equation) 来确定溶液的最终 pH 值。
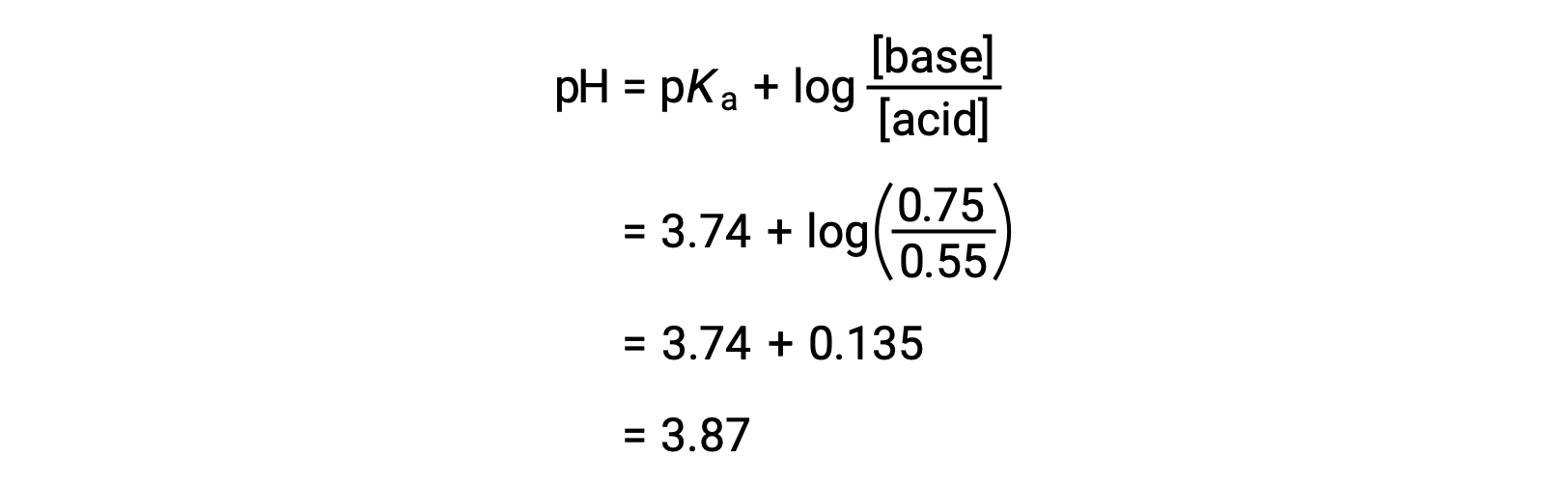
因此,添加 0.10 mol NaOH 后,溶液的 pH 值从 3.74 增加到 3.87。


