13.10: Pasos Determinantes de la Velocidad
Relacionando los Mecanismos de Reacción
En un mecanismo de reacción de varios pasos, uno de los pasos elementales progresa significativamente más lento que los otros. Este paso más lento se denomina paso limitante de la velocidad (o paso determinante de la velocidad). Una reacción no puede proceder más rápido que su paso más lento y, por lo tanto, el paso determinante de la velocidad limita la velocidad de reacción general.
El concepto de paso determinante de la velocidad se puede entender desde la analogía de una autopista de 4 carriles con un corto tramo de cuello de botella en el tráfico causado por el cierre de un carril. Al igual que el cuello de botella que afecta la velocidad global a la que los vehículos podrían viajar, el paso elemental más lento influye en la velocidad de reacción neta.
Las leyes de velocidad pueden derivarse directamente de las ecuaciones químicas balanceadas para las reacciones elementales. Sin embargo, este no es el caso de la mayoría de las reacciones químicas, donde las ecuaciones balanceadas a menudo representan el cambio general en el sistema químico, resultante de los mecanismos de reacción de varios pasos. Por lo tanto, la ley de velocidades debe determinarse a partir de datos experimentales y el mecanismo de reacción debe deducirse posteriormente de la ley de velocidad.
Por ejemplo, considere la reacción de NO2 y CO:
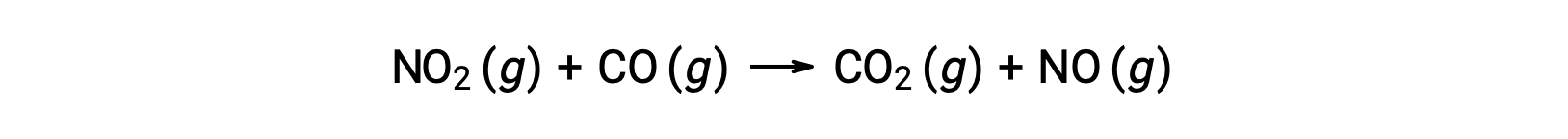
La ley de velocidad experimental para esta reacción a temperaturas superiores a 225 °C es:
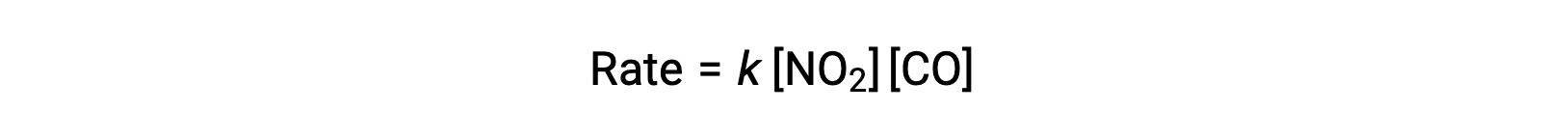
Según la ley de velocidad, la reacción es de primer orden con respecto a NO2 y de primer orden con respecto a CO. Esto es consistente con un mecanismo bimolecular de un solo paso, y es posible que este mecanismo de reacción sea válido para este proceso químico a altas temperaturas.
Sin embargo, a temperaturas inferiores a 225 °C, la reacción es descrita mediante una ley de velocidad diferente que es de segundo orden con respecto a NO2:
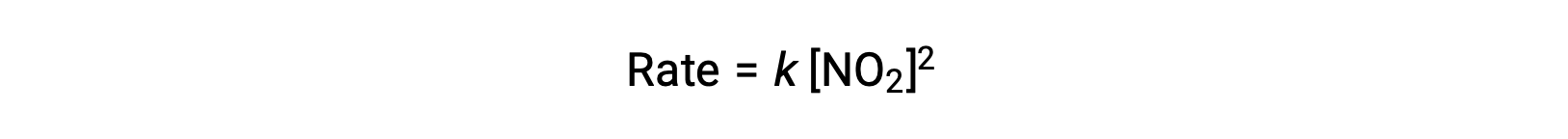
Esta ley de velocidad no es coherente con el mecanismo de un solo paso, pero es coherente con el siguiente mecanismo de dos pasos:
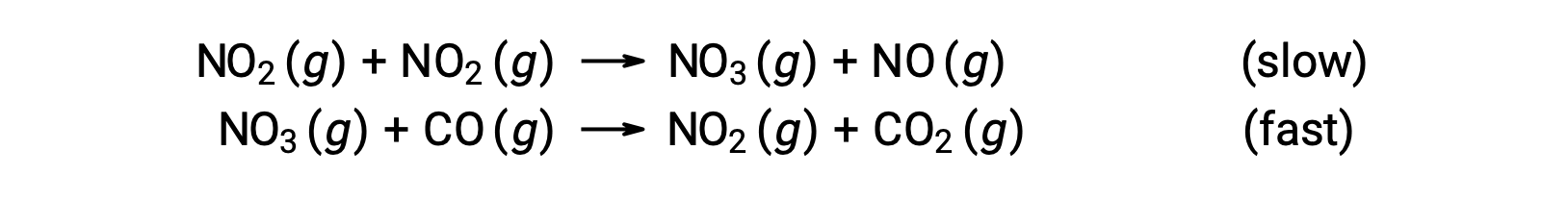
El paso determinante de la velocidad (el más lento) da una ley de velocidad que muestra la dependencia de segundo orden de la concentración de NO2, y la suma de las dos ecuaciones elementales da la reacción neta general.
En general, cuando el paso determinante de la velocidad (el más lento) es el primer paso en el mecanismo de la reacción, la ley de velocidad para la reacción general es la misma que la ley de velocidad para este paso. Sin embargo, cuando el paso que determina la tasa es precedido por un paso elemental que implica una reacción rápidamente reversible, la ley de velocidad para la reacción general puede ser más difícil de obtener, a menudo debido a la presencia de intermediarios de la reacción.
En tales casos, se puede utilizar el concepto de que una reacción reversible está en equilibrio cuando las velocidades de los procesos de avance y retroceso son iguales.
Por ejemplo, considere la reacción elemental reversible en la que NO se dimeriza para producir una especie intermedia N2O2. Cuando esta reacción está en equilibrio:
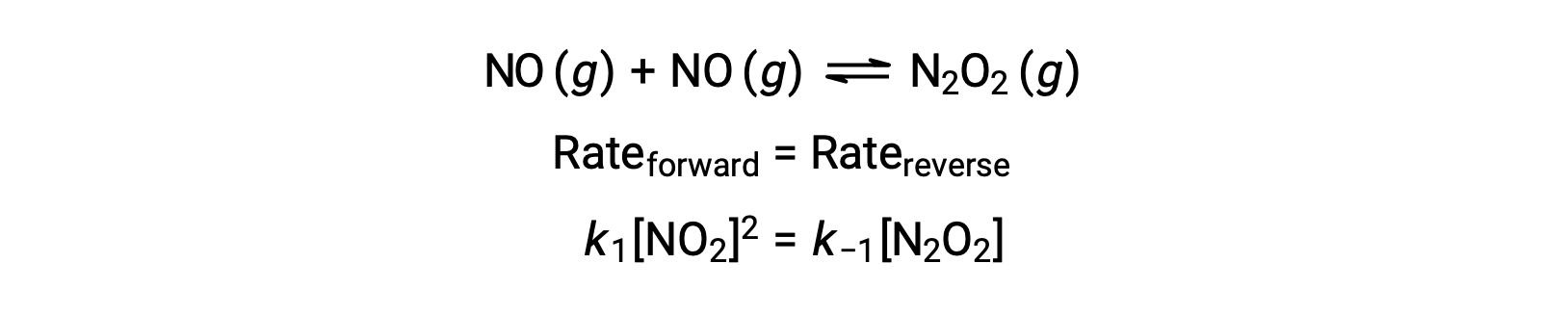
Esta expresión puede reorganizarse para expresar la concentración del intermediario en términos del reactivo NO:
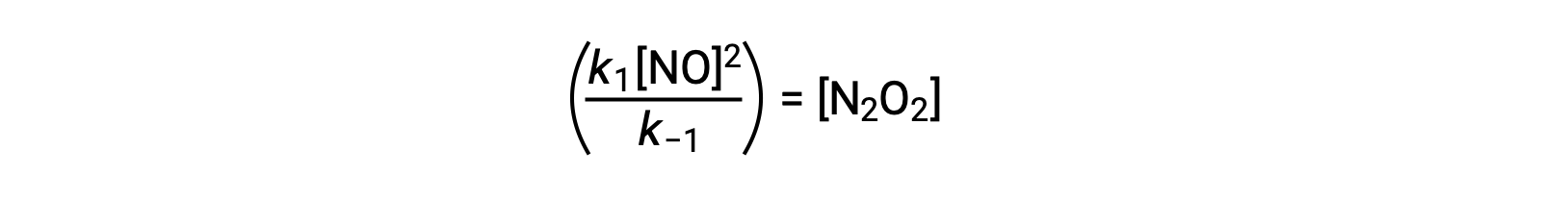
Este enfoque se puede utilizar en la formulación de leyes de velocidad para reacciones generales cuando hay intermediarios de reacción presentes.
Ejemplo de obtención de la ley de velocidad a partir de un mecanismo de reacción
Considere una reacción entre el monóxido de nitrógeno y el cloro molecular, para la cual se propone un mecanismo de dos pasos como se muestra:
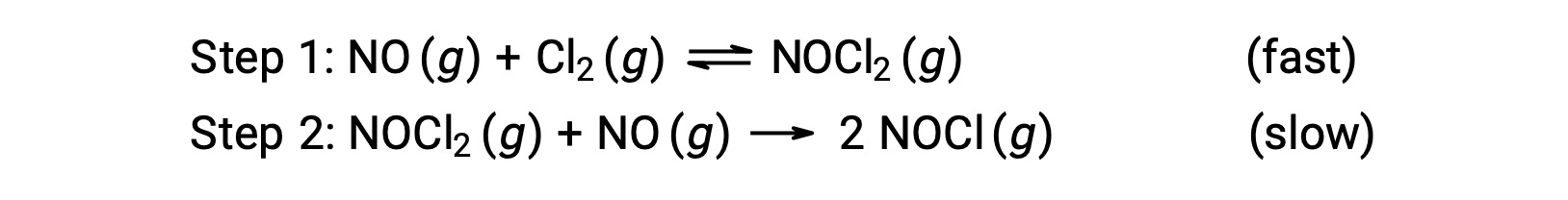
Este mecanismo se puede utilizar para obtener la ecuación y predecir la ley de velocidad para la reacción general. Inicialmente, agregando las dos reacciones elementales, se obtiene la ecuación para la reacción general.
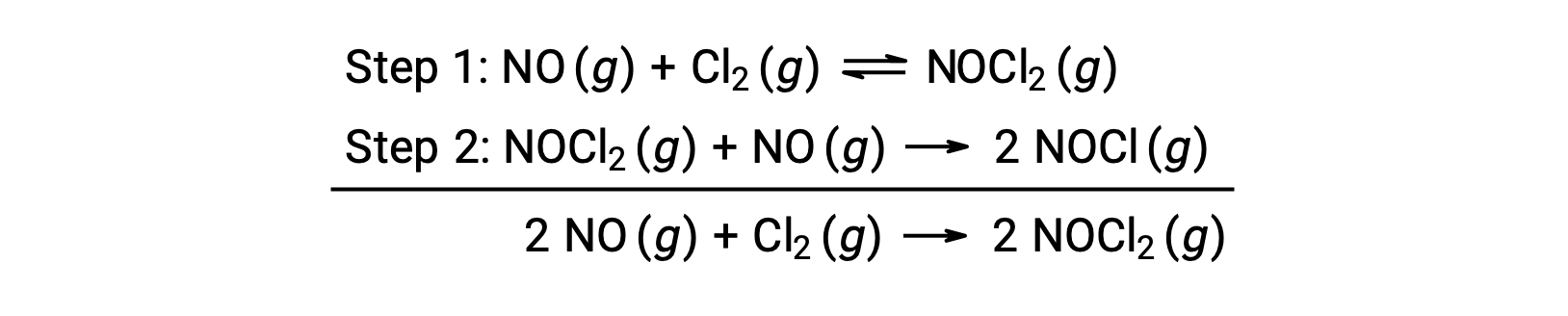
Para obtener una ley velocidad de este mecanismo, se escriben las leyes de velocidad para cada uno de los dos pasos elementales:
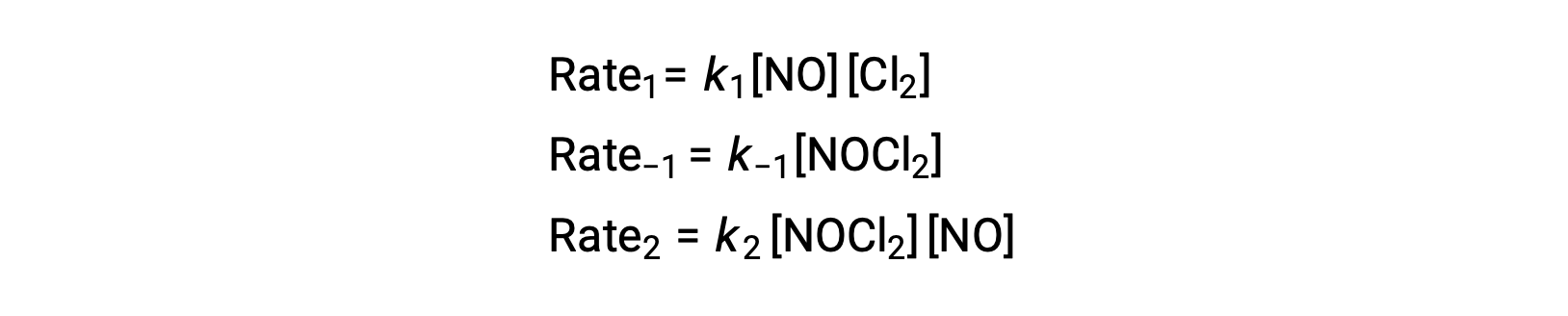
De acuerdo con el mecanismo de reacción propuesto, el paso 2 es el paso determinante de la velocidad. Por lo tanto, la ley de velocidad para la reacción general debe ser la misma que la ley de velocidad para este paso elemental. Sin embargo, la ley de velocidad para el paso 2 contiene una concentración de especies intermediarias, [NOCl2]. Para modificar esto, la ley de velocidad del primer paso elemental se utiliza para obtener una expresión de la concentración de intermediarios en términos de concentraciones de reactantes.
Suponiendo que el Paso 1 está en equilibrio;
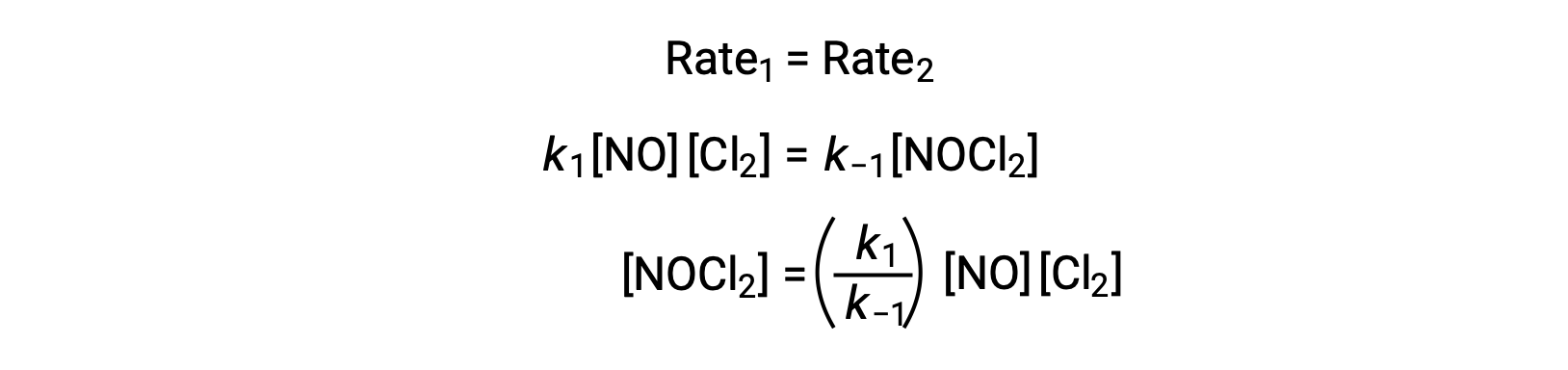
Si se sustituye esta expresión en la ley de velocidades para el paso 2, se obtiene:
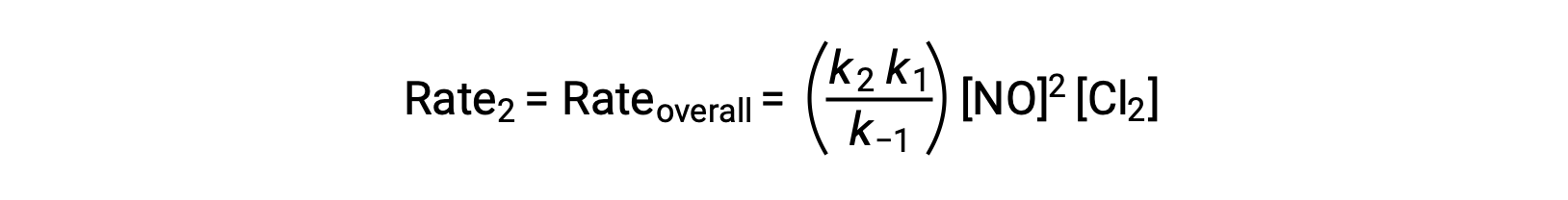
Este texto es adaptado de Openstax, Química 2e, Sección 12.6: Mecanismos de reacción.


